Anvisa suspende e ordena o recolhimento de pó utilizado em confeitaria da marca Sugar Art
Lote de sal grosso da marca Globo também foi atingido pela ação fiscal. Confira o lote.
A Anvisa determinou, nesta segunda-feira (26/1), o recolhimento do pó para decoração da marca Sugar Art. O produto, que é da empresa Madi Comércio e Indústria de Artigos para Festas e Artesanatos Ltda. (Madi Comércio), teve sua comercialização, distribuição, fabricação, divulgação e uso suspensos.
Ele contém materiais plásticos, o que o torna impróprio para ser consumido em alimentos.
Sal Grosso
Outro item atingido pela ação fiscal e que deve ser recolhido é o Sal Grosso Iodado (Ervas Finas) da marca Globo, fabricado pela Brasisal Alimentos Ltda. O produto também teve a sua comercialização, distribuição e consumo suspensos.
A medida afeta apenas o lote 004/24, cuja data de validade é 30 de outubro de 2026.
De acordo com o Laboratório Central de Saúde Pública do Rio de Janeiro (Lacen/RJ), o lote citado foi reprovado no teste de determinação de iodo.
O iodo deve ser adicionado ao sal de cozinha, para evitar a deficiência desse elemento no organismo, que pode levar ao bócio (aumento da tireoide). A falta de iodo também pode ocasionar vários problemas ao desenvolvimento do feto, durante a gestação, entre outros problemas.
Orientações
A Agência sugere aos consumidores que já tenham adquirido o produto que entrem em contato com a empresa, através do Serviço de Atendimento ao Cliente (SAC), para instruções a respeito do recolhimento do produto.
O telefone do SAC é 0800 585 0303 (Sal Globo).
Leia a Resolução no Diário Oficial da União
Boletim de janeiro destaca a disponibilização de três novos roteiros de inspeção harmonizados
Publicação traz ainda o perfil do novo assessor-chefe e outros assuntos. Confira!
Está disponível a edição 62 do Boletim SNVS, com as principais ações de vigilância sanitária realizadas neste mês de janeiro.
A edição destaca a disponibilização de três novos roteiros de inspeção harmonizados (ROI). Os documentos visam padronizar procedimentos e apoiar o trabalho de fiscais de visa de estados e municípios, facilitando a avaliação de risco em setores específicos:
- Serviços de estética classificados como serviços de saúde, disponível em ROI_Estética_Servico_Saúde
- Serviços Tipo III que realizam exames de análises clínicas (EACs), que pode ser acessado em ROI_EAC_TIPO_III
- Serviços itinerantes que realizam EACs
A iniciativa integra o projeto estratégico Serviço Seguro, que norteia a regulação com foco em gestão de risco, boas práticas e qualificação da assistência. Com os novos lançamentos, a Anvisa disponibiliza agora 19 roteiros harmonizados, além de outras ferramentas de apoio à fiscalização. A adoção desses instrumentos permite que a União, estados e municípios possam avaliar atualmente quase 17 mil serviços de saúde em todo o Brasil – como instituições de longa permanência para idosos (ILPIs), serviços de endoscopia, radiologia, centros cirúrgicos e mamografia. Os dados gerados são cruciais para priorizar ações e atualizar normas sanitárias.
Consulta pública – prevenção de infecções em serviços de saúde
O boletim destaca ainda a abertura da Consulta Pública (CP) sobre os requisitos de Boas Práticas para prevenir e controlar Infecções Relacionadas à Assistência à Saúde (IRAS), bem como a resistência aos medicamentos antimicrobianos e os surtos infecciosos em serviços de saúde (categoria que abrange hospitais, clínicas, ambulatórios, postos de saúde, etc).
A norma atualmente vigente sobre o tema (Portaria n° 2.616 /1998) é anterior à criação da Anvisa e tinha como foco os hospitais. Além de atualizar as regras para hospitais, a nova proposta prevê normas aplicáveis a todos os tipos de serviços de saúde, com medidas que se adaptem aos diferentes níveis de risco.
O texto também detalha melhor como devem ser a investigação e o monitoramento de surtos infecciosos e traz uma sessão específica sobre o gerenciamento de antimicrobianos (medicamentos destinados a combater micro-organismos como bactérias e vírus). A resistência microbiana eleva a gravidade das infecções e atualmente é um problema de saúde pública de preocupação mundial.
Pela norma proposta, todo serviço de saúde precisará ter ações de prevenção e controle de infecções planejadas e descritas, bem como os protocolos para execução dessas ações. Também deverão estar previstos, por exemplo, processos para higienização das mãos, para limpeza e desinfecção de superfícies e para o uso de Equipamentos de Proteção Individuais (EPI).
O texto foi construído com auxílio da Comissão Nacional de Prevenção e Controle de Infecções Relacionadas à Assistência à Saúde (CNCIRAS), de especialistas da sociedade científica e de universidades, além do Ministério da Saúde.
Como participar
A íntegra da proposta e os documentos que subsidiaram sua elaboração estão disponíveis neste link.
O prazo para contribuições começa em sete dias após a publicação da Consulta Pública no Diário Oficial da União (de 2/1/2026 a 1/4/2026). No link de acesso há um formulário eletrônico para preenchimento: as sugestões devem ser enviadas por meio desse formulário, que estará disponível quando se iniciar o prazo para contribuições.
Acesse a publicação completa neste link e fique por dentro das iniciativas do SNVS!
Leia também a edição de dezembro de 2026.
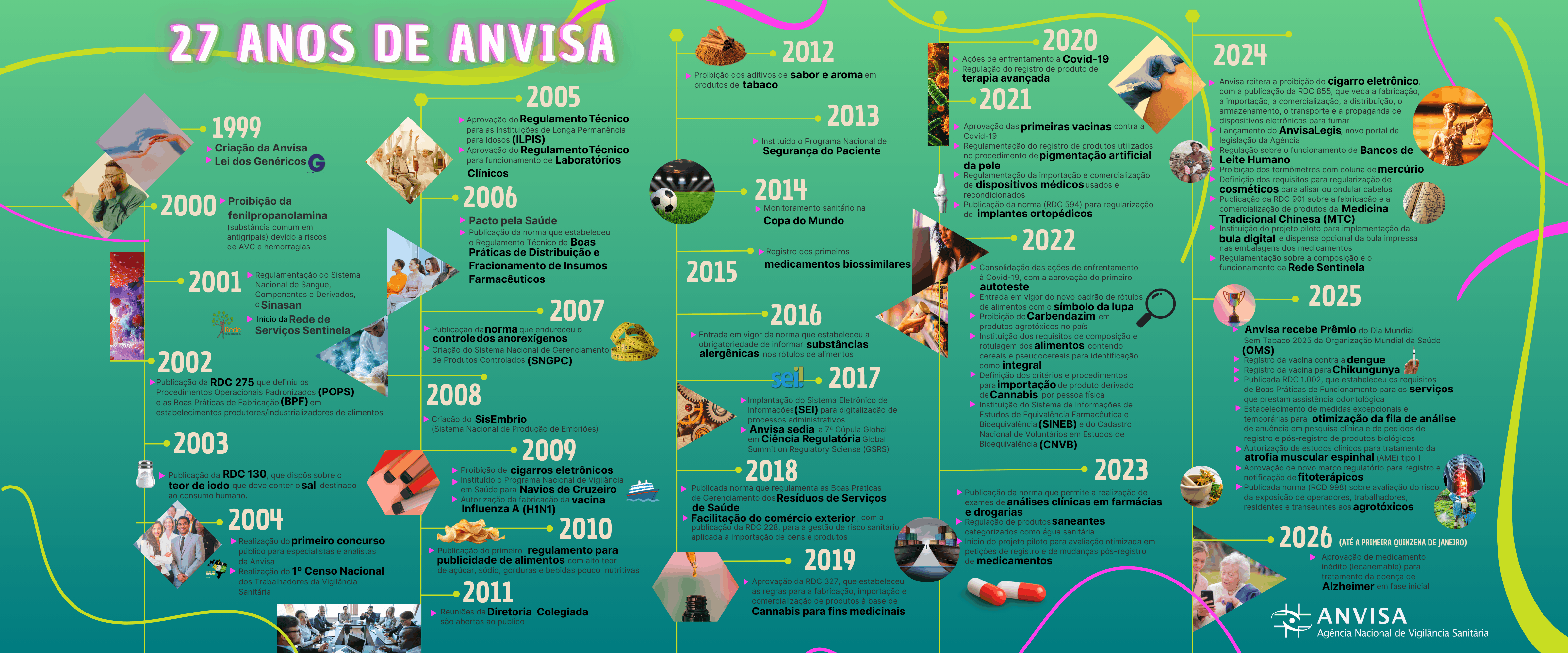
Anvisa completa 27 anos de defesa da saúde pública
Conheça um pouco da história, das conquistas, dos compromissos e desafios da Agência que se tornou referência internacional em vigilância sanitária.
A Anvisa completa 27 anos de existência nesta segunda-feira (26/1). Criada em 1999, por meio da Lei 9.782, a Agência nasceu num contexto de grandes desafios no Brasil. No percurso de sua história, promoveu diversos avanços que tiveram impacto significativo na vida da população, se tornando a potência que é hoje: um dos mais importantes órgãos do Sistema Único de Saúde (SUS) e referência internacional, com atuação em vários fóruns de regulação em âmbito global.
Para chegar até aqui e se consolidar como uma agência reguladora tecnicamente forte, contabilizando progressos e inovações em inúmeras áreas, a Anvisa manteve sempre o compromisso com a segurança, a eficácia e a qualidade dos produtos e serviços por ela regulados, tomando decisões ancoradas em dados e evidências científicas.
Essencial à vida dos brasileiros e à economia do país, a atuação da Anvisa abrange a regulamentação, registros e autorizações, a fiscalização e o monitoramento de produtos. Vinculada ao Ministério da Saúde, a Agência também é responsável pela coordenação do Sistema Nacional de Vigilância Sanitária (SNVS).
Para dar uma ideia do seu tamanho, a Anvisa regula setores que representam mais de 20% do Produto Interno Bruto (PIB) brasileiro, tais como as indústrias de alimentos, produtos para saúde, medicamentos, agrotóxicos, cosméticos, saneantes e tabaco.
A regulação inclui também os laboratórios analíticos, os serviços de saúde e a Farmacopeia Brasileira, além da vigilância sanitária de portos, aeroportos e fronteiras, bem como produtos terapêuticos e procedimentos que envolvem sangue, tecidos, células e órgãos.
Sim, é hora de olhar para o futuro. Mas é preciso também espiar pelo retrovisor e relembrar as conquistas. Vamos lá?
Participação social
Ao longo desse tempo, sobretudo nos últimos anos, a Anvisa intensificou mecanismos e canais para a participação social em temas técnicos. A força das decisões técnicas da Anvisa provém de uma ampla consulta à sociedade em cada passo da elaboração de normas ou da reformulação e da atualização de regulamentos.
As audiências públicas, as consultas públicas, a tomada pública de subsídio (TPS), os seminários abertos e com transmissão em tempo real para a apresentação de propostas da Agência, os canais permanentes e diretos de interação com a sociedade, a abertura para receber sugestões de temas que farão parte de sua agenda regulatória, a transmissão em tempo real das reuniões da Diretoria da Anvisa são alguns exemplos do respeito às contribuições da população, à efetiva participação social.
Estamos falando do comprometimento da Agência com as melhores práticas regulatórias, a partir de diálogos com todos os atores, além da realização de análise de impacto regulatório bem estruturada e da avaliação de resultados das normas. Tanto é assim que, em maio de 2025, a Anvisa foi contemplada com o Selo Ouro de Qualidade Regulatória, a mais alta distinção concedida pela Federação das Indústrias do Estado de São Paulo (Fiesp).
Marcos regulatórios
A Anvisa está focada em estabelecer novos marcos regulatórios, que respondam aos desafios de um mundo em permanente transformação, com grandes e revolucionárias descobertas técnico-científicas.
No último trimestre de 2025, foram publicadas resoluções sobre as boas práticas para os serviços de odontologia e avaliação de risco ocupacional a agrotóxicos. A Resolução da Diretoria Colegiada (RDC) 1.002/2025 estabeleceu os requisitos de Boas Práticas de Funcionamento para todos os serviços que prestam assistência odontológica no país. A norma tem como objetivo garantir qualificação profissional, humanização da atenção e gestão, além de reduzir e controlar os riscos sanitários para profissionais, pacientes, comunidade e meio ambiente.
Já a RDC 998/2025 regulamentou a avaliação de risco ocupacional e de exposição a agrotóxicos. Até então, a regulação brasileira tratava, principalmente, do risco para consumidores, por meio de resíduos de agrotóxicos nos alimentos. Ou seja, o Brasil passou a contar, pela primeira vez, com regras claras para verificar o risco de exposição a agrotóxicos para trabalhadores, operadores, residentes e pessoas que passam por áreas onde esses produtos são usados.
Também em fins de 2025, a Anvisa aprovou o novo marco para medicamentos fitoterápicos no Brasil. A Resolução 1.004/2025 definiu as categorias de medicamento fitoterápico e de medicamento tradicional fitoterápico e estabeleceu, de forma complementar ao previsto na RDC 948/2024, os requisitos mínimos para o registro de medicamentos fitoterápicos, e para o registro e a notificação de medicamentos tradicionais fitoterápicos.
Um dos pontos centrais na atualização dessa norma são os extratos vegetais que dão origem ao fitoterápico, com a alteração na forma pela qual as indústrias produzem e operam esses extratos. Em resumo, a nova regra simplificou os processos a fim de permitir a ampliação do uso da biodiversidade em fitoterápicos. Isso porque, apesar de ter a maior biodiversidade do mundo, o Brasil ainda possui um número reduzido de medicamentos fitoterápicos. Atualmente, há cerca de 350 regularizados na Anvisa.
Hoje estão em consulta novos marcos regulatórios, como o de alimentos e embalagens, dispositivos médicos e novas regras para produtos de cannabis medicinal.
Vacinas
A retrospectiva deste último período, que levou a Agência a completar 27 anos de existência, também aponta um horizonte bastante promissor no que diz respeito aos avanços no âmbito dos imunizantes.
Em dezembro de 2025, a Anvisa publicou o registro da vacina contra a dengue desenvolvida pelo Instituto Butantan. Esse ato marcou a conclusão do processo regulatório e permitiu a produção e a comercialização do imunizante no país. Trata-se da primeira vacina contra a dengue a ser produzida por um laboratório nacional, e que será ofertada exclusivamente pelo SUS.
Alguns meses antes, precisamente em abril, a Anvisa também aprovou o registro da primeira vacina para Chikungunya. O imunizante, também do Instituto Butantan, é indicado para a prevenção da doença em pessoas com 18 anos ou mais, que estejam em risco aumentado de exposição ao vírus. Para a publicação do registro, a Anvisa definiu, em conjunto com o Butantan, um Termo de Compromisso que prevê a realização de estudos de efetividade e segurança da vacina, e de atividades de farmacovigilância ativa para ampliar o conhecimento sobre o perfil de eficácia e segurança da vacina.
Terapias avançadas
A aprovação da norma sobre o registro sanitário de produtos de terapias avançadas estabeleceu as bases regulatórias para desenvolver e registrar produtos de alta tecnologia baseados em células e genes humanos, tornando-se referência na América Latina. Desde que o caminho foi aberto para que o país desenvolvesse e registrasse produtos a partir de células e genes humanos, pacientes que sofrem com enfermidades complexas e sem alternativas médicas renovam a esperança no sentido de ter mais qualidade de vida.
Exemplo disso é a autorização, em novembro de 2025, para os estudos clínicos com um produto de terapia avançada para tratamento da atrofia muscular espinhal (AME) tipo 1, a forma mais grave da doença. Trata-se de uma doença genética rara que provoca a perda progressiva da força muscular e pode comprometer a sobrevivência das crianças nos primeiros anos de vida.
O estudo está sendo desenvolvido por uma empresa norte-americana em parceria com a Fundação Oswaldo Cruz (Fiocruz). A Fiocruz participa diretamente do desenvolvimento clínico do produto e firmou um acordo de transferência de tecnologia. Assim sendo, uma vez registrado pela Anvisa, o medicamento poderá ser produzido no Brasil, contribuindo para a autonomia nacional no campo das terapias gênicas.
Alzheimer
Com o envelhecimento populacional, a doença de Alzheimer é tida como “mal do século”, sendo a principal causa de demência em idosos. Se é fato que o aumento da expectativa de vida é festejado, também é fato que as pessoas querem chegar à Melhor Idade com saúde e funções cognitivas preservadas.
Por isso foi tão comemorada, em janeiro deste ano, a aprovação de medicamento inédito para a doença. O lecanemabe é um anticorpo monoclonal da classe dos produtos biológicos aprovado pela Anvisa para a fase inicial do Alzheimer, ou seja, para as pessoas com diagnóstico de comprometimento cognitivo leve ou em estágio leve de demência. Com o registro, o lecanemabe está autorizado para distribuição e uso no país.
Controle do tabaco
A Anvisa foi premiada com o Prêmio do Dia Mundial Sem Tabaco 2025 da Organização Mundial da Saúde (OMS). A Agência se destacou devido a regulamentações pioneiras e também em função de uma firme resistência frente à indústria do tabaco. Em 2024, a Agência reafirmou a proibição dos dispositivos eletrônicos para fumar no país, após diversas consultas públicas e análises normativas.
Boas práticas
A Anvisa implantou padrões de qualidade em ambulatórios, clínicas, consultórios, hospitais e centros cirúrgicos. Entre os regulamentos, destacam-se as Boas Práticas em Serviços de Saúde e o Programa de Melhoria da Qualidade. Ou seja, a qualidade e a segurança dos serviços de saúde podem ser aferidas com base em normas da Agência.
Tem também os avanços no monitoramento dos eventos adversos desses ambientes, por meio da formação de redes nacionais que reportam dados sobre surtos, infecções e resistência microbiana. De posse dessas informações e articulada com as Vigilâncias Sanitárias estaduais e municipais, são adotadas medidas para responder às situações de crise, com a agilidade e a urgência necessárias.
Força de trabalho
Empenhada em recompor seus quadros técnicos, a Anvisa conseguiu autorização para convocar cerca de 100 aprovados no concurso de 2024 para nova turma do curso de formação, concluída em 21 de dezembro de 2025, com a aplicação da prova final. A chegada dos novos servidores irá fortalecer a capacidade regulatória do país e garantir respostas mais ágeis às demandas sanitárias. A força de trabalho reforçada contribui, por exemplo, para acelerar as análises processuais.
Cenário internacional
O reconhecimento da qualidade técnica das decisões tomadas pela Anvisa em âmbito interno e os posicionamentos defendidos pela instituição no ambiente das organizações internacionais e dos organismos multilaterais são reconhecidos mundo afora.
A Anvisa pertence ao grupo de reguladores com impactos globais, trabalhando não somente para proteger sua própria população, mas também para estabelecer padrões globais de qualidade, segurança e eficácia. Sua liderança e expertise são fundamentais em discussões internacionais sobre regulamentação de saúde e frequentemente colaboram com instituições como a Organização Mundial da Saúde (OMS) para melhorar a saúde em todo o mundo.
Otimização da fila de análise
A fim de reduzir o passivo regulatório, em novembro de 2025 foi publicada a RDC 997. A norma dispôs medidas excepcionais e temporárias para a otimização da fila de análise de anuência em pesquisa clínica e de pedidos de registros e pós-registro de medicamentos e produtos biológicos. A resolução terá vigência até 31 de dezembro deste ano. O objetivo é reduzir os prazos de análise, a partir da criação de uma força-tarefa na própria Agência e também do mecanismo chamado de reliance, ou seja, confiança regulatória.
Reliance, em inglês, ou confiança regulatória, é uma prática adotada por autoridades reguladoras de saúde para otimizar e acelerar seus processos decisórios. Trata-se da possibilidade de uma autoridade reguladora nacional considerar e utilizar, total ou parcialmente, as avaliações, inspeções e decisões de outras autoridades reguladoras confiáveis ou de instâncias internacionais, respeitando sempre sua soberania e independência.
O uso do reliance não significa delegar responsabilidades, mas reconhecer o valor do trabalho já realizado por outras autoridades, contribuindo para o uso mais eficiente de recursos, redução de retrabalho e promoção do acesso oportuno a produtos seguros, eficazes e de qualidade.
Vale lembrar também que hoje existe uma sala de situação dentro da Agência que acompanha a evolução das filas. Além disso, foi instituído um comitê de monitoramento para que todo esse processo seja acompanhado pela sociedade civil e pelo setor regulado, imprimindo transparência às ações.
E o tempo não para...
Isso tudo foi realizado em meio a desafios como o das pomadas capilares e pastas modeladoras – que causaram desde reações alérgicas a ceratites e cegueira temporária –, intoxicação por metanol e uso indevido e falsificações das canetas emagrecedoras. Todos esses desafios exigem da Anvisa respostas rápidas. No caso do metanol, a Agência tomou medidas para aumentar a produção de etanol farmacêutico e autorizar a importação excepcional do Fomepizol, usado como antídoto nos casos de intoxicação pela substância metanol.
Por tudo isso e muito mais, parabéns Anvisa!
27 anos Anvisa
Fonte: Anvisa, em 26.01.2026.
